In chimica, l'energia di dissociazione di legame, sovente indicata D0, è una misura della forza di un dato legame chimico. Viene definita come la variazione di entalpia standard quando un legame viene scisso omoliticamente, con reagenti e prodotti della scissione omolitica che si trovano alla temperatura di 0 K (zero assoluto). Per esempio, l'energia di dissociazione per uno dei legami C-H dell'etano è definita dal processo:
- CH3CH2-H → CH3CH2 H
- D0 = ΔH = 101,1 kcal/mol (423 kJ/mol)
L'energia di dissociazione di legame è talvolta chiamata anche entalpia di dissociazione di legame (o entalpia di legame), ma questi termini non sono concettualmente equivalenti, dato che si riferiscono alla entalpia di reazione allo stato standard, e differiscono da D0 di circa 1,5 kcal/mol (6 kJ/mol) nel caso di un legame con l'idrogeno.
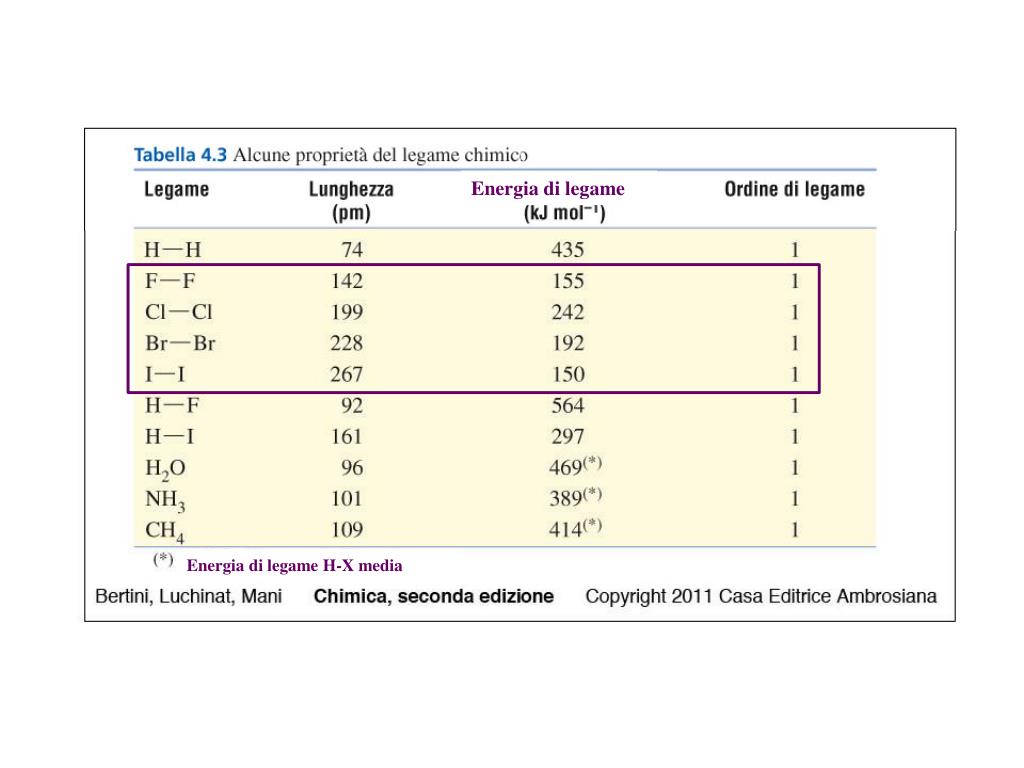
Eccetto nel caso delle molecole biatomiche, l'energia di dissociazione di legame è differente dall'energia di legame, che rappresenta una media calcolata a partire dalla somma delle energie di dissociazione di legame di tutti i legami in una molecola.
Per esempio, un legame O-H di una molecola di acqua (H-O-H) possiede energia di dissociazione pari a 493,4 kJ/mol, e 424,4 kJ/mol sono necessari per scindere l'altro O-H. L'energia di legame per il legame O-H nell'acqua è di 458,9 kJ/mol, che rappresenta la media dei valori.
Nello stesso modo per rimuovere gli atomi di idrogeno in modo successivo dal metano le energie di dissociazione di legame sono 104 kcal/mol (435 kJ/mol) per D(CH3-H), 106 kcal/mol (444 kJ/mol) per D(CH2-H), 106 kcal/mol (444 kJ/mol) per D(CH-H) e infine 81 kcal/mol (339 kJ/mol) per D(C-H). L'energia di legame è perciò 99 kcal/mol (414 kJ/mol), ovvero la media delle energie di dissociazione di legame.
Notare che tutte le dissociazioni descritte, se vengono formati nuovi legami a entalpie inferiori, allora si ha una perdita netta di energia, e perciò in totale un processo esotermico.
L'energia di dissociazione di legame eterolitico è implicata nella scissione del legame chimico tramite eterolisi piuttosto che omolisi.
Note